燃料電池とは
発電しながらお湯も作る、
エコなシステム。
燃料電池について4つのポイントをご紹介します。
ボタンをクリックすると、各ポイントを詳しくご覧いただけます
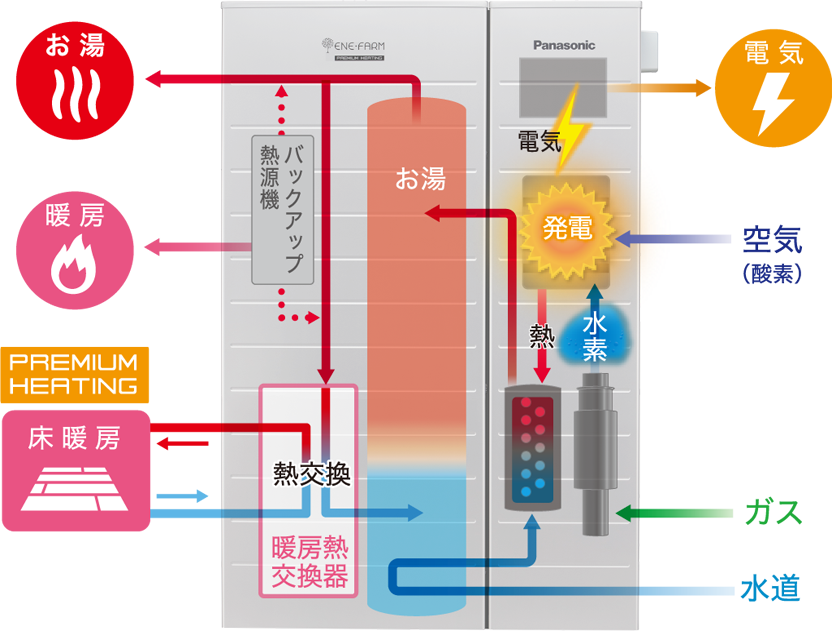
- 燃料電池のしくみ 燃料電池は、水素と酸素が反応し
水に変化する過程で電気を発生させます。 - 水の電気分解とは 燃料電池の発電は、
「水を電気分解すると水素と酸素にわかれる」という
「水の電気分解」の原理を応用しています。 - 主な4つの方式 燃料電池は、使用されている電解質の違いにより、
大きく4つの方式に分類されます。 - ご家庭への燃料(水素)供給 家庭用燃料電池は、都市ガス・LPガスから
水素を取り出して発電しています。
燃料電池のしくみ
燃料電池とは、乾電池などの一次電池や、充電してくり返し使用する二次電池のように、蓄えられた電気を取り出す『電池』とは異なり、水素と酸素の電気化学反応により発生した電気を継続的に取り出すことができる『発電装置』です。
燃料電池は、発電装置

発電装置としては、工場、事業所などで利用されている内燃機関を動力源にした発電機や、火力発電所などのタービンを動力源にした発電機などがあり、身近なものでは、自転車のライト用の発電機があります。
例えば、内燃機関により運転する発電機の場合、燃料の燃焼反応によって取り出されるエネルギーによりエンジンを回し(運動エネルギー)、発電用コイルを介し、電気エネルギーに変換しています。
燃料電池では、水素を燃料として供給することで、酸素との電気化学反応により取り出される電気エネルギーを電力として利用します。このように、化学反応に伴うエネルギーを電気エネルギーに直接変換することから、発電時のエネルギー効率が高く、水素と酸素の反応により水が生成されるだけで、廃棄物が排出されないことからクリーンな次世代の『発電装置』として期待されています。
燃料電池が発電するしくみ
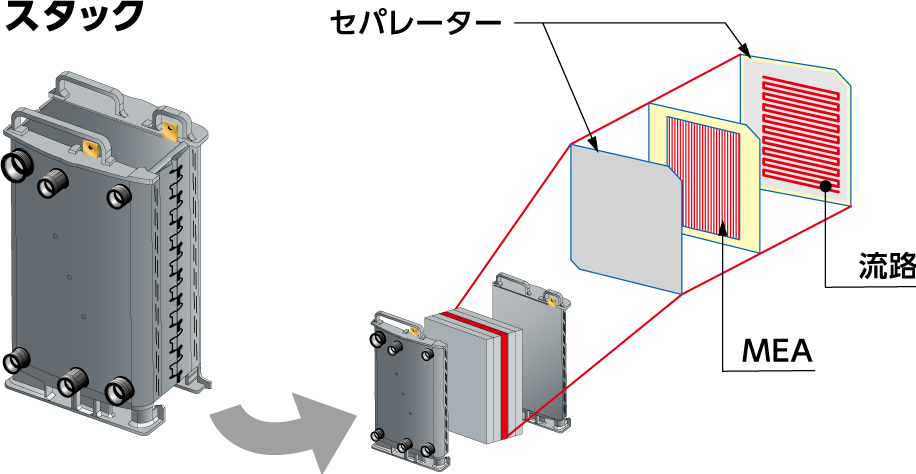
燃料電池が発電をおこなう部分は『スタック』と呼ばれ、このスタックはセパレーターにはさみ込まれたMEA(触媒を有する燃料極と空気極でイオン交換膜を挟んだ三層構造体)の集合体で構成されています。
個々のセパレーターには、燃料となる水素(水素リッチガス)や酸素(空気)を流すための流路が形成され、MEAの燃料極に水素、空気極に酸素が供給されるようになっており、このMEAにおける電気化学反応により発電をおこなっています。
MEAにおける発電のしくみ
(1) 1個の電子を持った水素が燃料極(-)へ触れると、電子を離し、水素イオンに変化します。
H2→2H++2e-
(2) 燃料極(-)で取り出された電子が、燃料極(-)から接続された電気回路を通って空気極(+)へ流れることで、電気が発生(発電)します。
(電子は電解質の中を通ることができないため、電気回路としての導線の中を流れます。)
(3) 燃料極(-)で電子を失った水素イオンは電解質の中に入りますが、電気的に不安定なため、空気極(+)で安定しようと電子を取り込み酸素と化合し、水が生成されます。
2H++2e-+1/2O2→H2O
このように、燃料電池は、水素と酸素が反応し水に変化する過程で電気を発生させる装置であり、原理的には「燃料電池は、水の電気分解の逆で発電する」と説明されます。
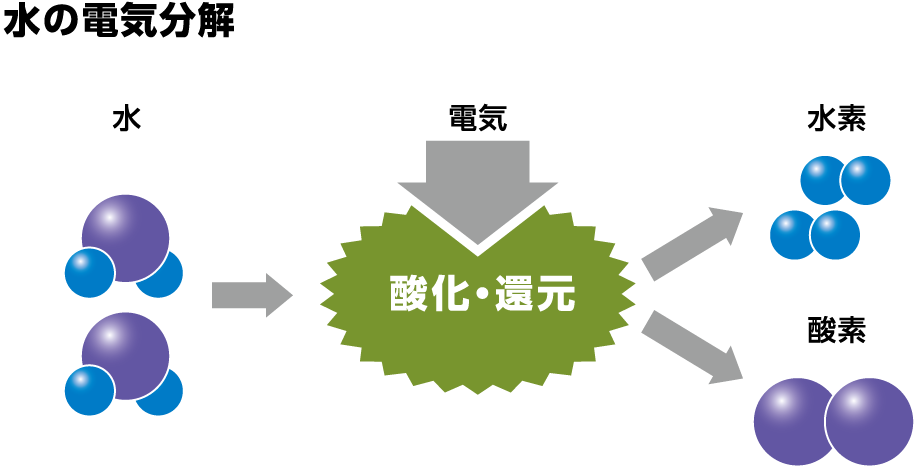
水の電気分解とは
燃料電池は、「水を電気分解すると水素と酸素にわかれる」という「水の電気分解」の原理を応用して発電していますが、この「水の電気分解」とは、水に電圧を加えることにより起こる水の酸化還元反応のことをいいます。
このとき、陰極(-)で還元反応が起こり水素が、陽極(+)で酸化反応が起こり酸素が発生します。
水の電気分解
(1) 電解液*1の中では、水(H2O)は、水素イオン(H+)と水酸化物イオン(OH-)に分離しています。
2H2O→2H++2OH-
(2) この電解液の中に入れられた電極に電圧をかけると、陰極(-)では水素イオンに電子が与えられ、還元が起こり、水素が発生します。
2H++2e-→H2↑
(3) 陽極(+)では、水酸化物イオンから電子が奪われ、酸化が起こり、酸素と水が生成されます。
2OH-→H2O+1/2O2↑+2e-
*1:純粋な「水」は電気分解しにくいため、電気伝導性を高める水酸化ナトリウムなどを加えた溶液のこと。
水の電気分解と燃料電池の発電
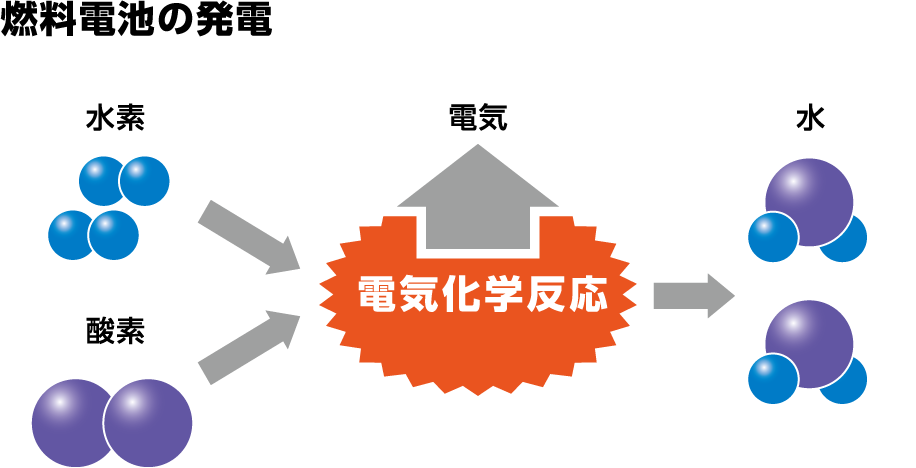
このように、水の電気分解では、水に電圧を加える(電気を流す)ことで、水素と酸素に分解しています。
それに対して、燃料電池は水素と酸素を反応させ、その過程で電気を発生させています。
主な4つの方式
燃料電池は、使用されている電解質の違いにより、発電効率や運転温度等が異なり、それぞれに想定されている用途が異なってきます。
固体高分子形燃料電池(PEFC)
電解質材料にイオン交換膜を使用するもので、発電効率は30~40%(HHV)であるものの、運転温度が70〜90℃と低く燃料電池を構成する機器の小型化が可能なことから、家庭用や自動車用の燃料電池として実用化されています。
りん酸形燃料電池(PAFC)
電解質材料に、炭化ケイ素粉末をテフロンバインダーで結着した支持板に濃厚りん酸を含浸させたものを使用するもので、発電効率が35〜42%(HHV)で、動作温度が180〜200℃前後と、工場や事業所のコージェネレーション発電設備として実用化されています。
溶融炭酸塩形燃料電池(MCFC)
燃料として水素を用い、電解質材料にセラミック多孔体に炭酸カリウムなどを充填したものを使用するもので、発電効率が約40~50%(HHV)で、動作温度が600~700℃となり、火力発電所等の高出力の発電設備の代替としての用途が期待されています。
固体酸化物形燃料電池(SOFC)
電解質材料にジルコニア系セラミックスなどを使用するもので、発電効率は40~65%(HHV)と高くなりますが、動作温度が700~1,000℃のため、火力発電所等の高出力の発電設備の代替としての用途が期待されているとともに、家庭用の燃料電池として実用化されています。
主な仕様
| 固体高分子形燃料電池 | りん酸形燃料電池 | 溶融炭酸塩形燃料電池 | 固体酸化物形燃料電池 | |
|---|---|---|---|---|
| 電解質 材料 |
固体高分子膜 | りん酸水溶液 | 溶融炭酸塩 | ジルコニア系セラミックス |
| 運転 温度 |
70~90℃ | 180~200℃ | 600~700℃ | 700~1,000℃ |
| 発電 効率 (HHV) |
30~40% | 35~42% | 約40~50% | 約40~65% |
| 想定 出力 |
~100kW | ~1,000kW | 100~100,000kW | ~100,000kW |
| 想定 用途 |
家庭用、小型業務用 自動車用、携帯端末用 |
業務用、工業用 | 工業用、分散電源用 火力代替 |
家庭用、業務用、工業用 分散電源用、火力代替 |
ご家庭への燃料(水素)供給
燃料電池は、水素を燃料とするため、水素ガスそのものを供給する場合、新たな燃料供給インフラを整備しなければなりません。また、高圧圧縮されている水素ガスや、極低温の液化水素などは、LPガスのように一般のご家庭では容易に取り扱うことができません。
既存のインフラを利用し、家庭で水素を生成
水素は、天然ガスやナフサなどの化石資源から水蒸気改質法*1、部分酸化法*2、自己熱改質法*3などの方法で製造されています。中でも、天然ガスの水蒸気改質法については、広く実用化された方法で、触媒を充填した反応器の中で、天然ガスと水蒸気を反応させる過程で、水素を取り出すことができます。
家庭用燃料電池では、都市ガス(主成分:メタン(CH4))やLPガス(主成分:プロパン(C3H8))
を燃料とし、水蒸気改質法による「改質」により水素を生成する方法を採用し、既存の燃料供給のインフラを活用しています。また、必要な所で水素を生成するので、扱いにくい水素を貯蔵、運搬する必要もありません。
但し、水蒸気改質法で水素を取り出す場合、炭素を含んだ化石資源からの改質であるため、二酸化炭素(CO2)や一酸化炭素(CO)が発生します。
一酸化炭素(CO)は燃料電池の化学反応に悪影響があるため、水を加えた変成反応や、酸素を加える酸化反応などで、二酸化炭素(CO2)に変えたり、触媒へ吸着させる機構(設備)が必要になります。
*1:メタンを原料とし、水蒸気を使用して水素を得る改質方法で、最も一般的に工業化されている水素の製造方法です。
*2:灯油のような炭化水素と空気を反応させて水素を主成分とするガスを製造する改質方法です。
*3:部分酸化による発熱と水蒸気改質による吸熱を制御し、熱の出入をバランスさせながら水素を製造する改質方法です。
燃料処理器のしくみと役割
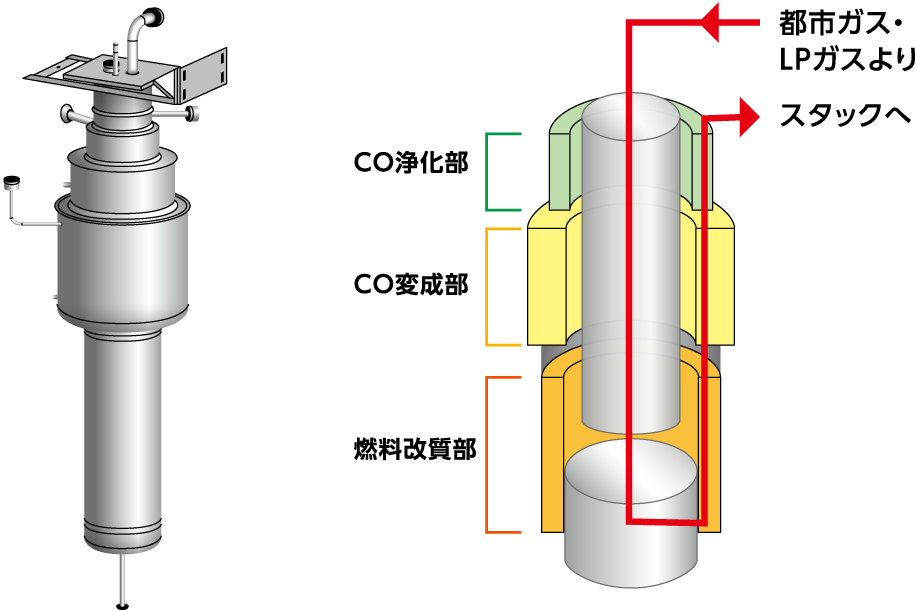
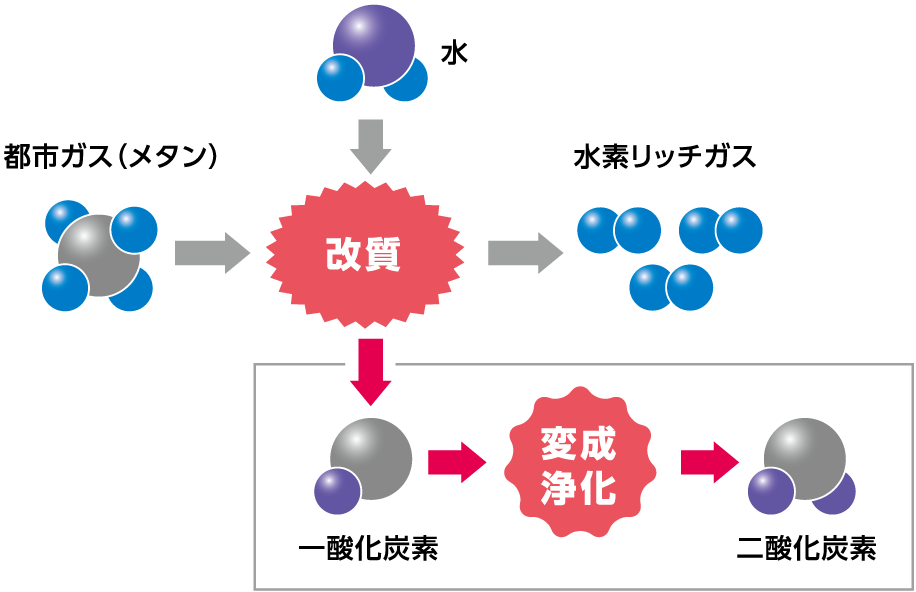
燃料処理器は、燃料改質部と、CO変成部、CO浄化部からなるCO処理部で構成されており、都市ガス中のメタン(LPガス中のプロパン)と水蒸気を反応させ、水素を生成する役割を担っています。
燃料改質部の役割
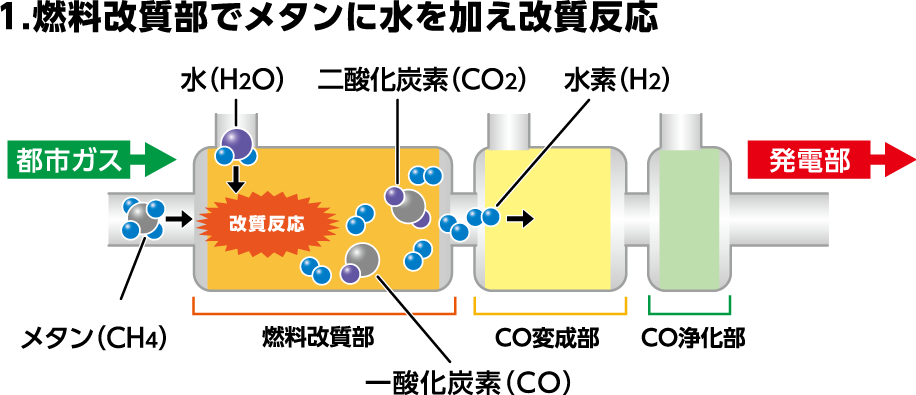
燃料改質部では水素の生成をおこないます。燃料である炭化水素ガス(ここでは都市ガスを例に説明します)と水(水蒸気)の改質反応を起こさせるため、バーナーにより反応が起こる温度に安定させます。都市ガス(メタン)が供給され、水(水蒸気)と混ざり合うことで改質反応が起こり、水素と二酸化炭素や一酸化炭素を生成します。
CH4+2H2O→4H2+CO2
CH4+H2O→3H2+CO(約10〜15%)
CO変成部の役割
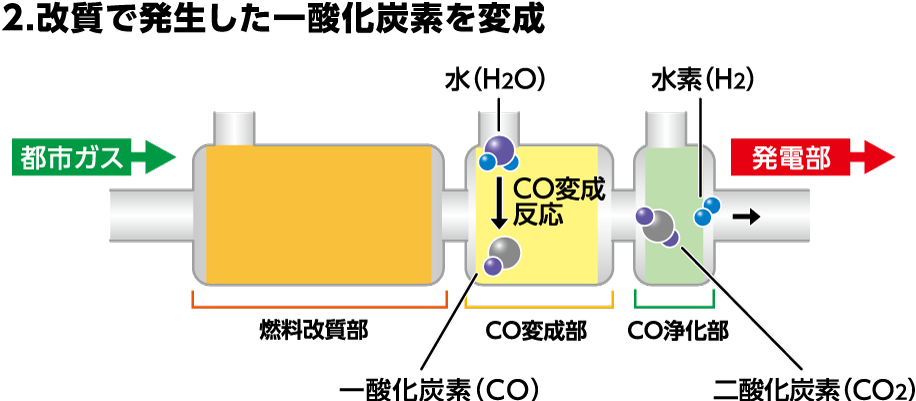
CO変成部では、改質反応で発生した一酸化炭素と水(水蒸気)によるCO変成反応で二酸化炭素と水素を生成します。
CO+H2O→H2+CO2(CO:0.5%に低減)
CO浄化部の役割
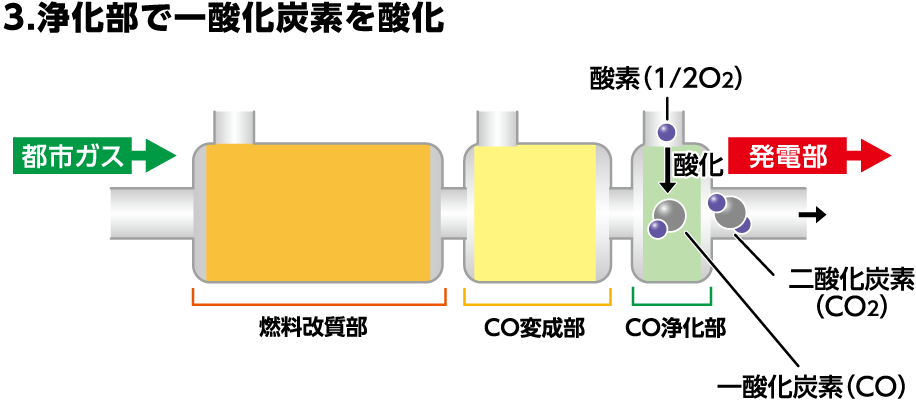
CO浄化部では、改質によって発生する一酸化炭素を、スタックでの発電に影響しない濃度まで低減します。
残された一酸化炭素に酸素を加え、酸化させることで二酸化炭素へ変化させ、一酸化炭素を取り除きます。
CO+1/2O2→CO2(CO:10ppm以下に低減)
このように、家庭用燃料電池では、都市ガスやLPガスなどの既存の燃料供給インフラをそのまま活用するため、水素を生成する燃料処理器が併設され、家庭へ容易に水素を供給することができるのです。
